SCandiumScandium mit dem Elementsymbol Sc und der Ordnungszahl 21 ist leicht wasserlöslich, reagiert mit heißem Wasser und verdunkelt sich leicht an der Luft. Seine Hauptvalenz ist +3. Es wird häufig mit Gadolinium, Erbium und anderen Elementen gemischt, mit geringer Ausbeute und einem Gehalt von etwa 0,0005 % in der Erdkruste. Scandium wird häufig zur Herstellung von Spezialglas und leichten Hochtemperaturlegierungen verwendet.
Derzeit betragen die nachgewiesenen Scandiumreserven der Welt lediglich 2 Millionen Tonnen. 90–95 % davon sind in Bauxit-, Phosphorit- und Eisentitanerzen enthalten und ein kleiner Teil in Uran-, Thorium-, Wolfram- und Seltenerd-Erzen. Die Vorkommen sind hauptsächlich in Russland, China, Tadschikistan, Madagaskar, Norwegen und anderen Ländern verbreitet. China ist sehr reich an Scandiumvorkommen und verfügt über enorme Scandium-Mineralreserven. Unvollständigen Statistiken zufolge betragen die Scandiumreserven in China etwa 600.000 Tonnen. Diese befinden sich in Bauxit- und Phosphoritlagerstätten, Porphyr- und Quarzgang-Wolframlagerstätten in Südchina, Seltenerdlagerstätten in Südchina, der Seltenerd-Eisenerzlagerstätte Bayan Obo in der Inneren Mongolei und der Vanadium-Titan-Magnetit-Lagerstätte Panzhihua in Sichuan.
Aufgrund der Scandiumknappheit ist auch der Scandiumpreis sehr hoch. In der Spitze war der Scandiumpreis auf das Zehnfache des Goldpreises gestiegen. Obwohl der Scandiumpreis gefallen ist, ist er immer noch viermal so hoch wie der Goldpreis!
Geschichte entdecken
1869 bemerkte Mendelejew eine Lücke in der Atommasse zwischen Calcium (40) und Titan (48) und sagte voraus, dass es hier auch ein unentdecktes Element mittlerer Atommasse gebe. Er sagte voraus, dass dessen Oxid X ₂ O Å sei. Scandium wurde 1879 von Lars Frederik Nilson von der Universität Uppsala in Schweden entdeckt. Er förderte es aus der schwarzen Seltengoldmine, einem komplexen Erz, das acht Arten von Metalloxiden enthält. Er hatErbium(III)-oxidaus schwarzem seltenem Golderz und gewonnenYtterbium(III)-oxidVon diesem Oxid gibt es ein weiteres Oxid eines leichteren Elements, dessen Spektrum zeigt, dass es sich um ein unbekanntes Metall handelt. Dies ist das von Mendelejew vorhergesagte Metall, dessen OxidSc₂O₃Das Scandiummetall selbst wurde hergestellt ausScandiumchloriddurch elektrolytisches Schmelzen im Jahr 1937.
Mendelejew
Elektronenkonfiguration
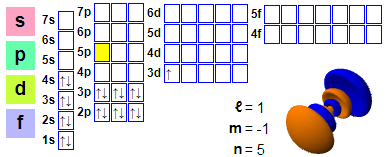
Elektronenkonfiguration: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Scandium ist ein weiches, silberweißes Übergangsmetall mit einem Schmelzpunkt von 1541 °C und einem Siedepunkt von 2831 °C.
Nach seiner Entdeckung wurde Scandium lange Zeit nicht verwendet, da es sich nur schwer gewinnen ließ. Mit der zunehmenden Verbesserung der Trennverfahren für Seltene Erden gibt es nun einen ausgereiften Prozessablauf zur Reinigung von Scandiumverbindungen. Da Scandium weniger alkalisch als Yttrium und Lanthanoide ist, ist das Hydroxid am schwächsten. Daher wird das scandiumhaltige Seltenerd-Mischmineral durch die Methode der „Stufenfällung“ von den Seltenen Erden getrennt, bei der Scandium(III)-hydroxid nach der Überführung in Lösung mit Ammoniak behandelt wird. Eine andere Methode besteht darin, Scandiumnitrat durch polare Zersetzung von Nitrat abzutrennen. Da Scandiumnitrat am leichtesten zersetzbar ist, kann Scandium abgetrennt werden. Darüber hinaus ist die umfassende Rückgewinnung von Scandium aus Uran-, Thorium-, Wolfram-, Zinn- und anderen Mineralvorkommen ebenfalls eine wichtige Scandiumquelle.
Nachdem eine reine Scandiumverbindung erhalten wurde, wird diese in ScCl Å umgewandelt und zusammen mit KCl und LiCl geschmolzen. Das geschmolzene Zink dient als Kathode für die Elektrolyse, wodurch sich Scandium an der Zinkelektrode abscheidet. Anschließend wird das Zink verdampft, um metallisches Scandium zu erhalten. Dies ist ein leichtes silberweißes Metall mit sehr aktiven chemischen Eigenschaften, das mit heißem Wasser unter Bildung von Wasserstoffgas reagieren kann. Daher wird das im Bild gezeigte metallische Scandium in einer Flasche versiegelt und mit Argongas geschützt, da Scandium sonst schnell eine dunkelgelbe oder graue Oxidschicht bildet und seinen metallischen Glanz verliert.
Anwendungen
Beleuchtungsindustrie
Scandium wird hauptsächlich in sehr hellen Bereichen eingesetzt und man kann es ohne Übertreibung als Sohn des Lichts bezeichnen. Die erste Wunderwaffe des Scandiums ist die Natrium-Scandiumlampe, mit der Tausende von Haushalten beleuchtet werden können. Es handelt sich um eine Halogen-Metalldampflampe: Die Glühbirne ist mit Natriumiodid und Scandiumtriiodid gefüllt, und gleichzeitig werden Scandium- und Natriumfolie hinzugefügt. Bei einer Hochspannungsentladung emittieren Scandiumionen und Natriumionen Licht ihrer charakteristischen Wellenlängen. Die Spektrallinien von Natrium liegen bei 589,0 und 589,6 nm, zwei bekannten gelben Lichtern, während die Spektrallinien von Scandium bei 361,3 bis 424,7 nm liegen und eine Reihe von Emissionen im nahen Ultraviolett und Blaulicht umfassen. Da sie sich ergänzen, ist die insgesamt erzeugte Lichtfarbe weißes Licht. Gerade weil Scandium-Natrium-Lampen sich durch hohe Lichtausbeute, gute Lichtfarbe, Energieersparnis, lange Lebensdauer und starke Nebelbrechung auszeichnen, werden sie häufig für Fernsehkameras, Plätze, Sportstätten und die Straßenbeleuchtung eingesetzt und gelten als Lichtquelle der dritten Generation. In China wird dieser Lampentyp allmählich als neue Technologie gefördert, während er in einigen Industrieländern bereits Anfang der 1980er Jahre weit verbreitet war.
Die zweite Wunderwaffe des Scandiums sind Solarphotovoltaikzellen, die das auf dem Boden gestreute Licht sammeln und in Strom umwandeln können, der die menschliche Gesellschaft antreibt. Scandium ist das beste Barrieremetall in metallischen, isolierenden, halbleitenden Silizium-Solarzellen und Solarzellen.
Seine dritte Wunderwaffe ist die γ-A-Strahlenquelle. Diese Wunderwaffe kann selbst hell leuchten, doch dieses Licht ist für das bloße Auge nicht wahrnehmbar; es handelt sich um einen hochenergetischen Photonenstrom. 45Sc wird üblicherweise aus Mineralien gewonnen, das einzige natürliche Isotop von Scandium. Jeder 45Sc-Kern enthält 21 Protonen und 24 Neutronen. 46Sc, ein künstliches radioaktives Isotop, kann als γ-Strahlenquelle oder als Traceratom auch zur Strahlentherapie bösartiger Tumore eingesetzt werden. Weitere Anwendungen sind der Yttrium-Gallium-Scandium-Granat-Laser.ScandiumfluoridInfrarot-Glasfaser und Scandium-beschichtete Kathodenstrahlröhre im Fernsehen. Es scheint, dass Scandium mit Helligkeit geboren wird.
Legierungsindustrie
Scandium in elementarer Form wird häufig zur Dotierung von Aluminiumlegierungen verwendet. Bereits die Zugabe von einigen Tausendsteln Scandium zu Aluminium führt zur Bildung einer neuen Al3Sc-Phase, die eine Metamorphose der Aluminiumlegierung bewirkt und deren Struktur und Eigenschaften deutlich verändert. Die Zugabe von 0,2–0,4 % Scandium (ähnlich dem Salzanteil in gebratenem Gemüse, nur eine kleine Menge erforderlich) erhöht die Rekristallisationstemperatur der Legierung um 150–200 °C und verbessert die Warmfestigkeit, die Strukturstabilität, die Schweißeigenschaften und die Korrosionsbeständigkeit deutlich. Außerdem kann dadurch die Versprödung vermieden werden, die bei längerer Arbeit bei hohen Temperaturen leicht auftreten kann. Hochfeste und hochzähe Aluminiumlegierungen, neue hochfeste korrosionsbeständige schweißbare Aluminiumlegierungen, neue Hochtemperatur-Aluminiumlegierungen, hochfeste, neutronenbestrahlungsbeständige Aluminiumlegierungen usw. bieten sehr attraktive Entwicklungsaussichten in der Luft- und Raumfahrt, der Luftfahrt, bei Schiffen, in Kernreaktoren, in leichten Fahrzeugen und in Hochgeschwindigkeitszügen.
Scandium ist außerdem ein hervorragender Modifikator für Eisen. Schon eine geringe Menge Scandium kann die Festigkeit und Härte von Gusseisen deutlich verbessern. Darüber hinaus kann Scandium auch als Additiv für hochtemperaturbeständige Wolfram- und Chromlegierungen verwendet werden. Scandium wird nicht nur für die Herstellung von Hochzeitskleidung verwendet, sondern hat auch einen hohen Schmelzpunkt und eine ähnliche Dichte wie Aluminium. Es wird auch in hochschmelzenden Leichtmetalllegierungen wie Scandium-Titan-Legierungen und Scandium-Magnesium-Legierungen verwendet. Aufgrund seines hohen Preises wird es jedoch in der Regel nur in der High-End-Fertigung wie Space Shuttles und Raketen eingesetzt.
Keramikmaterial
Scandium, eine einzelne Substanz, wird üblicherweise in Legierungen verwendet, und seine Oxide spielen in ähnlicher Weise eine wichtige Rolle in keramischen Werkstoffen. Das tetragonale Zirkonoxid-Keramikmaterial, das als Elektrodenmaterial für Festoxidbrennstoffzellen verwendet werden kann, weist die einzigartige Eigenschaft auf, dass die Leitfähigkeit dieses Elektrolyts mit zunehmender Temperatur und Sauerstoffkonzentration in der Umgebung zunimmt. Die Kristallstruktur dieses Keramikmaterials selbst kann jedoch nicht stabil sein und hat keinen industriellen Wert. Um die ursprünglichen Eigenschaften zu erhalten, ist die Dotierung mit Substanzen erforderlich, die diese Struktur fixieren. Die Zugabe von 6–10 % Scandiumoxid wirkt wie eine Betonstruktur, sodass Zirkonoxid auf einem quadratischen Gitter stabilisiert werden kann.
Darüber hinaus gibt es technische Keramikwerkstoffe wie hochfestes und hochtemperaturbeständiges Siliziumnitrid als Verdichter und Stabilisator.
Als VerdichterScandiumoxidkann am Rand feiner Partikel eine feuerfeste Phase Sc2Si2O7 bilden und so die Hochtemperaturverformung technischer Keramik verringern. Im Vergleich zu anderen Oxiden kann es die mechanischen Hochtemperatureigenschaften von Siliziumnitrid besser verbessern.
Katalytische Chemie
In der chemischen Verfahrenstechnik wird Scandium häufig als Katalysator eingesetzt, während Sc₂O₃ zur Dehydratation und Desoxidation von Ethanol oder Isopropanol, zur Essigsäurezersetzung und zur Ethylenherstellung aus CO und H₂ eingesetzt werden kann. Der Sc₂O₃-haltige Pt₁₀-Al-Katalysator ist zudem ein wichtiger Katalysator für Schwerölhydrierungs-, -reinigungs- und -raffinationsprozesse in der petrochemischen Industrie. Bei katalytischen Crackreaktionen wie Cumol ist die Aktivität des Sc-Y-Zeolith-Katalysators 1000-mal höher als die des Aluminiumsilikat-Katalysators. Im Vergleich zu einigen herkömmlichen Katalysatoren sind die Entwicklungsaussichten von Scandium-Katalysatoren sehr gut.
Kernenergieindustrie
Durch Zugabe einer kleinen Menge Sc2O3 zu UO2 im Kernbrennstoff eines Hochtemperaturreaktors können Gitterumwandlung, Volumenzunahme und Rissbildung durch die Umwandlung von UO2 in U3O8 vermieden werden.
Brennstoffzelle
Ebenso erhöht die Zugabe von 2,5 bis 25 % Scandium zu Nickel-Alkali-Batterien deren Lebensdauer.
Landwirtschaftliche Züchtung
In der Landwirtschaft können Samen wie Mais, Rüben, Erbsen, Weizen und Sonnenblumen mit Scandiumsulfat behandelt werden (die Konzentration beträgt im Allgemeinen 10-3 bis 10-8 mol/l, je nach Pflanze unterschiedlich), und die tatsächliche keimfördernde Wirkung wird erzielt. Nach 8 Stunden erhöhte sich das Trockengewicht der Wurzeln und Knospen im Vergleich zu Sämlingen um 37 % bzw. 78 %, der Mechanismus wird jedoch noch untersucht.
Von Nielsens Beschäftigung mit der Atommasse bis heute ist Scandium erst seit hundert oder zwanzig Jahren in den Blick der Menschen gerückt, blieb aber fast hundert Jahre lang auf der Bank. Erst die rasante Entwicklung der Materialwissenschaften im späten letzten Jahrhundert brachte ihm neue Vitalität. Heute sind Seltenerdelemente, darunter auch Scandium, zu heißen Stars der Materialwissenschaft geworden. Sie spielen in Tausenden von Systemen eine sich ständig verändernde Rolle, bringen täglich mehr Komfort in unser Leben und schaffen einen wirtschaftlichen Wert, der noch schwieriger zu messen ist.
Veröffentlichungszeit: 29. Juni 2023